Uncategorized
Đánh giá kỹ thuật về điện phân nước tách rời và không màng
Điện phân nước sử dụng điện để sản xuất hydro và oxy. Các máy điện phân thông thường kết hợp phản ứng giải phóng hydro (HER) và phản ứng giải phóng oxy (OER), xảy ra trong các ngăn catốt và anot được ngăn cách bởi một màng. Mặc dù sự tách biệt này ngăn ngừa sự trộn lẫn nguy hiểm giữa hydro và oxy, nhưng nó cũng làm tăng chi phí của máy điện phân và hạn chế hiệu suất cũng như hoạt động động của nó trong các điều kiện tải thay đổi đặc trưng của năng lượng mặt trời và năng lượng gió. Trong bài đánh giá này, các chiến lược và công nghệ để tách rời các phản ứng giải phóng hydro và oxy theo thời gian và/hoặc không gian sẽ được thảo luận. Điện phân nước tách rời (DWE) sử dụng các chất trung gian oxy hóa khử, chẳng hạn như axit phosphomolybdic (H₃PMo₁₂O₄₀) hoặc niken (oxy) hydroxit (Ni(OH)₂/NiOOH), để làm trung gian cho quá trình trao đổi ion (H⁺ hoặc OH⁻) giữa catốt và anot, do đó tạo ra hydro và oxy riêng biệt ở các giai đoạn hoặc các máy điện phân khác nhau. Ngoài ra, các cặp oxy hóa khử như axit silicotungstic (H₄SiW₁₂O₄₀) hoặc bromua/bromat (Br⁻/BrO₃⁻) có thể luân phiên lưu trữ và giải phóng hydro hoặc oxy, phân hủy phản ứng giải phóng hydro hoặc oxy thành các phản ứng điện hóa và hóa học, do đó đạt được DWE hiệu suất cao. Do đó, so với phương pháp điện phân thông thường, nguy cơ trộn lẫn hydro và oxy được giảm thiểu, đặc biệt là ở dòng điện thấp, cho phép vận hành an toàn trong điều kiện tải thấp một phần, điều này rất quan trọng đối với việc phát điện mặt trời và điện gió. I. Giới thiệu
Trong phương pháp điện phân nước thông thường, oxy và hydro được tạo ra đồng thời và phải được giữ riêng biệt—chỉ cần 4% hydro theo thể tích trong oxy có thể tạo thành hỗn hợp có khả năng gây nổ. Trong các thiết bị điện phân thương mại, màng ngăn hoặc màng ngăn đóng vai trò như một bộ phận phân tách, chia pin thành hai ngăn để ngăn hydro được tạo ra ở catốt trộn lẫn với oxy được tạo ra ở anot.
Tuy nhiên, vẫn có một số sự giao thoa khí xảy ra thông qua quá trình khuếch tán, kéo và vận chuyển chất điện phân tuần hoàn. Tốc độ hydro đi vào ngăn chứa anot (chứa oxy) chỉ tăng nhẹ theo dòng điện. Các yếu tố này có nghĩa là khi mật độ dòng điện giảm xuống dưới một phần nhất định của điểm đặt định mức, lượng oxy được tạo ra trong ngăn anot không đủ để pha loãng sự giao thoa hydro từ ngăn catot và nồng độ hydro trong oxy có thể vượt quá ngưỡng an toàn là 2% theo thể tích. Sự giao thoa hydro này hạn chế khả năng hoạt động của các máy điện phân thông thường ở một số tải thấp, hạn chế khả năng phản ứng động của chúng với toàn bộ phạm vi dao động công suất từ các nguồn năng lượng tái tạo như mặt trời và gió. Hơn nữa, dao động công suất làm giảm hiệu suất của chúng và đẩy nhanh quá trình lão hóa của chúng. Một trở ngại khác đối với việc sản xuất hydro xanh trong các máy điện phân thông thường là phản ứng giải phóng oxy (OER), thường có động học chậm hơn và tổn thất quá thế cao hơn so với phản ứng giải phóng hydro (HER). Việc ghép nối OER và HER có nghĩa là quá trình sản xuất hydro buộc phải hoạt động ở cùng tốc độ với giai đoạn sản xuất oxy. Điện phân nước tách rời (DWE) giải quyết một số hạn chế của phương pháp điện phân thông thường bằng cách tách quá trình giải phóng hydro và oxy thành hai giai đoạn riêng biệt có thể xảy ra ở những thời điểm khác nhau (Hình 1a), ở tốc độ khác nhau và ở những vị trí khác nhau (Hình 1b).
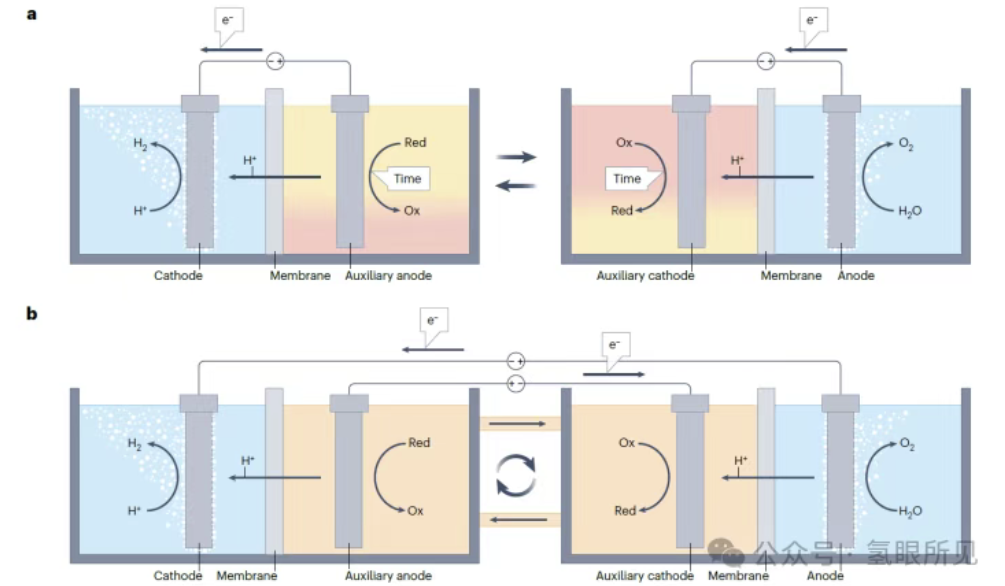
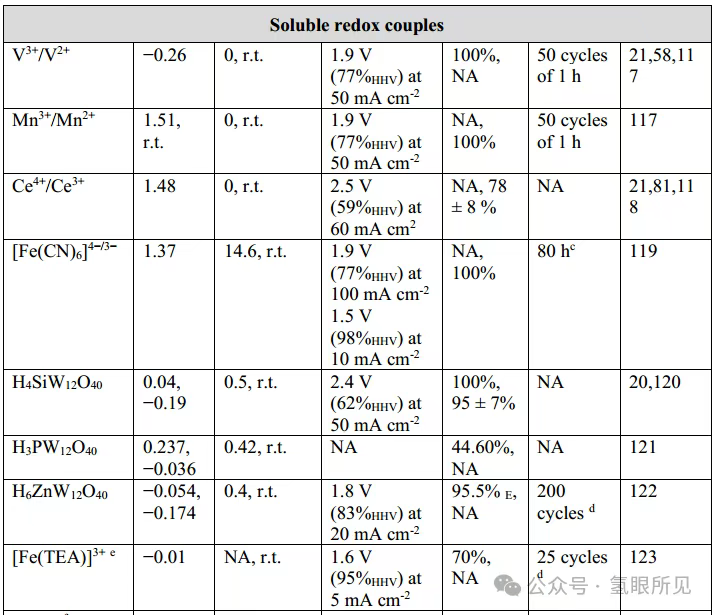
Hình 1: Quy trình điện phân nước tách rời. Điện phân nước tách rời (DWE) có thể được thực hiện trong các buồng điện phân riêng biệt (quy trình liên tục) hoặc theo các bước riêng biệt (quy trình mẻ). a: DWE axit sử dụng chất trung gian oxy hóa khử hòa tan trong quy trình mẻ. b: Phương pháp DWE axit liên tục sử dụng chất trung gian oxy hóa khử hòa tan trong buồng điện phân hai buồng. Ox: chất trung gian oxy hóa; Red: chất trung gian khử.
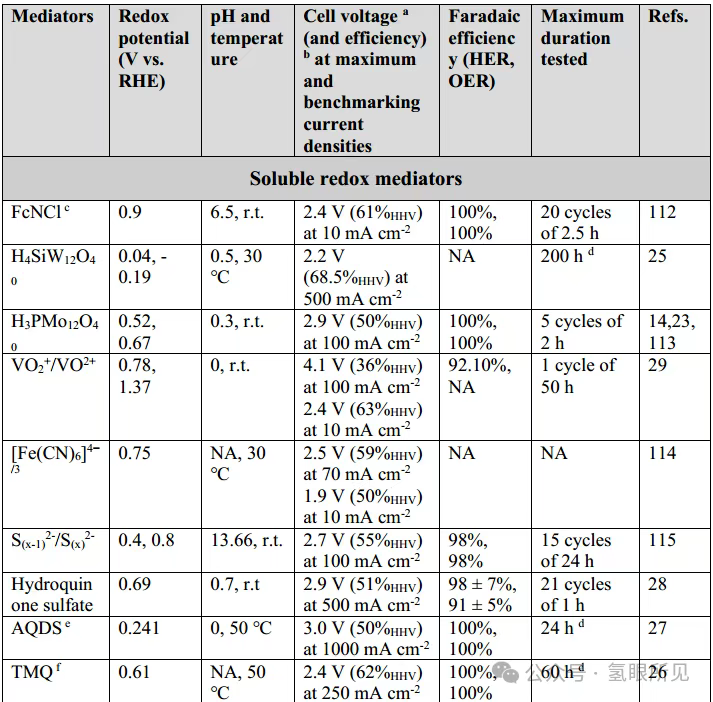
DWE sử dụng chất trung gian oxy hóa khử phù hợp, chẳng hạn như axit phosphomolybdic polyoxometalate tan trong nước (H₃PMo₁₂O₄₀), để trung gian quá trình trao đổi ion H⁺ và OH⁻ giữa catốt và anot. Kể từ báo cáo đầu tiên về điện phân tách rời, nhiều chất trung gian oxy hóa khử và thiết kế hệ thống thay thế đã được phát triển (Bảng 1 bên dưới).
Những cải tiến bao gồm việc sử dụng các chất trung gian oxy hóa khử thể rắn và thay thế một trong các bước điện hóa trong quá trình điện phân tách rời bằng một chu trình điện hóa-hóa học tạo ra hydro hoặc oxy (Bảng 2 bên dưới). Việc sản xuất hydro và oxy tách rời cũng đã được chứng minh là cho phép thực hiện điện phân không màng một cách thực tế, giúp giảm chi phí hệ thống. Trong bài viết này, chúng tôi thảo luận về điện phân tách rời và DWE không màng (một kiến trúc điện phân tách các phản ứng giải phóng hydro và oxy trong một điện phân duy nhất, không bị chia cắt). Hóa học và công nghệ điện phân được xem xét và so sánh với các điện phân thông thường.

- Sản xuất hydro và oxy tách rời
Sản xuất hydro và oxy tách rời đòi hỏi sự trao đổi ion H⁺ hoặc OH⁻ giữa phản ứng thoát hydro catốt (HER) và phản ứng thoát oxy anốt (OER) trong chất điện phân có tính axit hoặc kiềm. Sự tách rời này xảy ra thông qua các chất trung gian oxy hóa khử (dạng hòa tan hoặc rắn) luân phiên lưu trữ và giải phóng ion H⁺ hoặc OH⁻. Các phương pháp khác kết hợp các phản ứng điện hóa và hóa học, hay các chu trình lắng đọng và hòa tan kim loại, để sản xuất hydro hoặc oxy ở các giai đoạn riêng biệt hoặc trong các bình điện phân riêng biệt.
- Chất trung gian oxy hóa khử hòa tan
Một chất trung gian oxy hóa khử hòa tan tốt cho phản ứng thủy phân xúc tác (DWE) phải có độ ổn định hóa học tuyệt vời và độ hòa tan cao trong nước ở cả dạng oxy hóa và dạng khử trong phạm vi nhiệt độ hoạt động của hệ thống. Độ hòa tan cao (0,5 M hoặc cao hơn) cho phép sử dụng nồng độ chất trung gian cao, giảm điện trở suất của dung dịch và cung cấp khả năng lưu trữ tốt cho proton và electron được tạo ra trong quá trình giải phóng oxy. Nồng độ chất trung gian cao cũng giảm thiểu ảnh hưởng của việc tiêu thụ chất trung gian trong quá trình khử và giúp ức chế các phản ứng giải phóng hydro cạnh tranh. Các chất trung gian oxy hóa khử hòa tan nên được lựa chọn sao cho thế sóng oxy hóa khử của chúng nằm giữa thế sóng khởi đầu giải phóng hydro và thế sóng khởi đầu giải phóng oxy tại các điện cực được sử dụng trong pin điện hóa. Điều này có nghĩa là khi oxy được tạo ra, chất trung gian sẽ được ưu tiên khử hơn là trải qua quá trình giải phóng hydro. Ngược lại, nếu chất trung gian bị oxy hóa điện hóa, quá trình có thể diễn ra mà không có sự giải phóng oxy cạnh tranh đáng kể. Vị trí của sóng oxy hóa khử của chất trung gian dẫn đến các (bất lợi) khác nhau và các chế độ hoạt động tiềm năng. Ví dụ, sóng oxy hóa khử hoạt động chính của axit silicotungstic nằm ở khoảng -0,2 V (so với điện cực hydro thuận nghịch, VRHE). Nếu quá trình khử chất trung gian xảy ra ở điện cực trơ (như carbon thủy tinh), quá trình khử hoàn toàn chất trung gian có thể đạt được mà không cần bất kỳ phản ứng giải phóng hydro cạnh tranh nào (HER). Sau đó, tiếp xúc với chất xúc tác HER hiệu quả (như Pt/C) trong buồng ngoài sẽ dẫn đến giải phóng hydro tự phát từ chất trung gian bị khử. Quá trình tiếp xúc này cho phép sản xuất hydro bên ngoài bình điện hóa với tốc độ rất nhanh (trên 1 mol H₂ trên mỗi mg chất xúc tác mỗi giờ), nhưng nó cũng ngụ ý sự kém hiệu quả cố hữu, vì chất trung gian khó khử hơn proton khi sử dụng catốt Pt/C trong bình điện hóa. Các chất trung gian có sóng oxy hóa khử dương hơn (gần với thế phản ứng giải phóng oxy hơn, chẳng hạn như cặp oxy hóa khử Ce⁴⁺/Ce³⁺) có thể tách OER, cho phép OER tự phát xảy ra bên ngoài bình điện hóa, một lần nữa lại làm giảm hiệu quả của quá trình điện hóa. Các chất trung gian với sóng oxy hóa khử nằm gần như chính xác ở giữa điểm bắt đầu của phản ứng hydro hóa và phản ứng oxy hóa khử cũng đã được báo cáo. Trong trường hợp này, phản ứng oxy hóa khử tự phát từ chất trung gian bị oxy hóa là không thể, cũng như phản ứng hydro hóa khử tự phát từ chất trung gian bị khử. Do đó, cần có các bước điện hóa để thực hiện cả hai bước, dẫn đến hai bộ tổn thất điện hóa và thường yêu cầu hai cell điện hóa riêng biệt. Việc phải sử dụng hai cell điện hóa riêng biệt thường gây bất lợi cho các hệ thống sử dụng chất trung gian oxy hóa khử ở điện thế trung gian so với các quy trình điện hóa một bước, mặc dù việc chia điện áp phân tách nước thành hai phần nhỏ hơn có một số lợi thế cho các ứng dụng bị giới hạn điện áp (ví dụ: cung cấp năng lượng cho phản ứng phân tách nước một nửa bằng một hoặc hai điện cực quang bán dẫn). Hơn nữa, các chất trung gian oxy hóa khử lý tưởng nên được cấu tạo từ các nguyên tố có sẵn trong đất, không độc hại, thân thiện với môi trường và không tốn kém. Phản ứng DWE ban đầu được thực hiện trong các cell hình chữ H nhỏ (Hình 1a ở trên), nhưng khi công nghệ ngày càng hoàn thiện, các thiết lập cell dòng chảy có khả năng mở rộng hơn đã được phát triển. Sử dụng chất trung gian oxy hóa khử đã được thiết lập là axit silicotungstic (H₄SiW₁₂O₄₀), hai thành phần tế bào điện phân liền kề đã được xây dựng: một để khử axit silicotungstic với quá trình giải phóng oxy kết hợp, và thành phần còn lại để giải phóng hydro với quá trình tái oxy hóa kết hợp của axit silicotungstic (Hình 1b). Axit silicotungstic được tuần hoàn liên tục giữa các tế bào điện hóa ở 30°C, tạo ra hydro và oxy ở mật độ dòng điện cao tới 500 mA cm⁻². Ở mật độ dòng điện 25 mA cm⁻², oxy được tạo ra cũng có độ tinh khiết cao (nhiễm hydro <0,4 vol%), so với nhiễm hydro 1,9 vol% trong dòng oxy của thiết bị điện phân thông thường sử dụng các thành phần tương tự hoạt động ở cùng mật độ dòng điện. Những kết quả này cho thấy rằng DWE có thể phù hợp để sản xuất hydro từ điện tái tạo (thường không liên tục và/hoặc công suất thấp). Chất trung gian oxy hóa khử hữu cơ là một khái niệm hấp dẫn vì chúng bao gồm các nguyên tố dồi dào và các đặc tính của chúng có thể được điều chỉnh thông qua sửa đổi cấu trúc. Tetramercaptopropanesulfonate quinone (TMQ) đã được sử dụng làm chất trung gian oxy hóa khử trong cấu hình tế bào dòng chảy liên tục. Hệ thống hoạt động ở mật độ dòng điện không đổi 250 mA cm⁻² ở 50°C, tạo ra hydro và oxy với hiệu suất Faradaic là 100%. TMQ được phát hiện là ổn định hơn chất trung gian oxy hóa khử quinone anthraquinone-2,7-disulfonate (AQDS) đã được báo cáo trước đó. Sau chín ngày thử nghiệm độ ổn định, khả năng tích điện của TMQ giảm dưới 1,5%, trong khi khả năng tích điện của AQDS giảm khoảng 26% trong cùng kỳ. Tuy nhiên, sau 61,8 giờ hoạt động liên tục trong hệ thống DWE, TMQ bị oxy hóa đã bắt đầu bị phân hủy. Kết quả này làm nổi bật vấn đề về độ ổn định lâu dài của các chất trung gian oxy hóa khử hữu cơ hòa tan; Các chất trung gian vô cơ, chẳng hạn như polyoxometalat, có xu hướng ổn định hơn. Hệ thống trung gian VO₂⁺/VO²⁺ có thể ghép nối một bộ điện phân màng trao đổi proton (PEM) cho hydro áp suất cao với một bình loại H cho oxy áp suất thấp. Hydro được sản xuất trong bình điện phân PEM, tại đó VO²⁺ bị oxy hóa thành VO₂⁺ ở mật độ dòng điện là 100 mA cm⁻². VO₂⁺ sau đó chảy vào bình loại H để tái sinh và sản xuất oxy ở mật độ dòng điện là 25 mA cm⁻². Sau khoảng 10 giờ, áp suất hydro ở phía catốt của bình điện phân PEM đạt 35 MPa. Tuy nhiên, hiệu suất Faradaic của quá trình giải phóng hydro đã giảm từ 92,1% ở áp suất khí quyển xuống 70,5% ở 35 MPa, có thể là do sự chuyển đổi của hydro từ phía catốt sang phía anot của bình loại H.
- Chất trung gian oxy hóa khử rắn
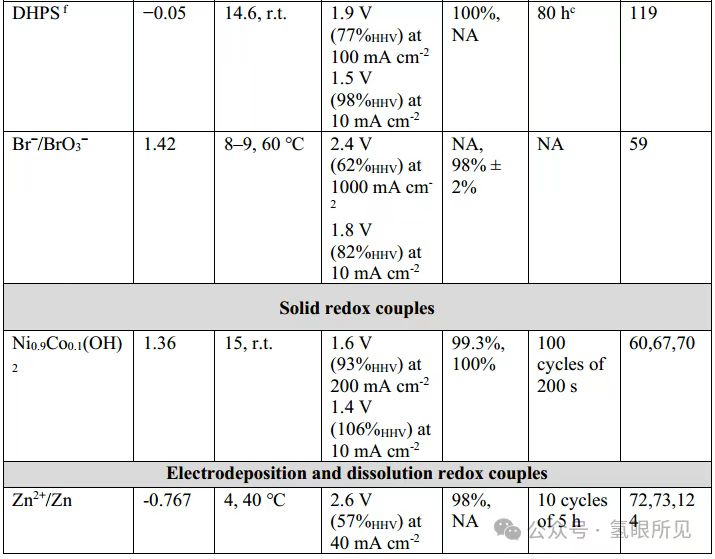
Các chất trung gian oxy hóa khử hòa tan tách rời các phản ứng tạo hydro và oxy theo thời gian và/hoặc không gian, nhưng chúng vẫn yêu cầu bộ điện phân phải được chia thành hai ngăn (như trong các bộ điện phân thông thường) để ngăn chặn sự chuyển dịch oxy hóa khử. Sự chuyển dịch oxy hóa khử xảy ra khi chất trung gian bị oxy hóa bị khử ở catốt hoặc chất trung gian bị khử bị oxy hóa ở anot, dẫn đến việc chất trung gian chuyển electron giữa hai điện cực mà không tạo ra hydro hoặc oxy ròng. Sự chuyển dịch này biểu hiện tổn thất Farada, đòi hỏi phải sử dụng bộ tách để ngăn chất trung gian di chuyển tự do bên trong bộ điện phân. Các bộ tách này có thể hiệu quả, nhưng chúng thường đắt tiền, thường là thành phần đầu tiên bị hỏng trong một pin điện hóa và làm tăng đáng kể điện trở của pin. Có thể tránh được các bộ tách như vậy bằng cách sử dụng các chất trung gian oxy hóa khử thể rắn dưới dạng các điện cực oxy hóa khử phụ trợ được gắn vào bộ điện phân. Cấu hình này mở đường cho quá trình điện phân không màng trong các pin không phân chia. Tiêu chí lựa chọn vật liệu cho chất trung gian oxy hóa khử trạng thái rắn tương tự như tiêu chuẩn cho các chất tương tự hòa tan của chúng, nhưng chúng không được hòa tan trong chất điện phân. Điện cực oxy hóa khử phải dẫn điện và có khả năng lưu trữ ion (H⁺ hoặc OH⁻) cao (các ion mà chúng trao đổi). Phản ứng oxy hóa khử của chúng với các ion này phải thuận nghịch, nhanh và có điện thế quá thấp (<50 mV). Lấy cảm hứng từ điện cực niken (oxy) hydroxit (Ni(OH)₂/NiOOH) trong pin niken-hydro, được biết là trải qua phản ứng oxy hóa khử thuận nghịch với các ion hydroxit (OH⁻) trong chất điện phân kiềm, niken (oxy) hydroxit có thể được sử dụng làm điện cực phụ để trung gian trao đổi OH⁻ giữa catốt và anot trong DWE kiềm không có màng (Hình 1c bên dưới). Điện cực Ni(OH)₂ bị khử phản ứng với các ion OH⁻ do HER tạo ra (2H₂O + 2e⁻ → H₂ + 2OH⁻), bị oxy hóa thành NiOOH trong quá trình này (Ni(OH)₂ + OH⁻ → NiOOH + H₂O + e⁻), do đó tạo ra hydro mà không tạo ra oxy. Oxy được tạo ra trong giai đoạn tiếp theo, trong đó điện cực NiOOH bị oxy hóa bị khử trở lại thành Ni(OH)₂, cung cấp các ion OH⁻ cho OER (4OH⁻ → O₂ + 2H₂O + 4e⁻). Nguyên lý tương tự cũng được sử dụng để tạo ra hydro và oxy đồng thời trong các bình điện phân riêng biệt bằng cách hoán đổi điện cực NiOOH/Ni(OH)₂ khi các điện cực trong hai bình điện phân đạt công suất hoạt động tối đa (Hình 1d bên dưới). Ngoài ra, việc luân phiên phân cực dòng điện khi các điện cực này đạt công suất hoạt động tối đa cho phép mỗi bình điện phân sản xuất hydro và oxy luân phiên. Chế độ hoạt động này đòi hỏi các điện cực lưỡng chức có khả năng tạo ra cả hydro và oxy trong điều kiện phân cực catốt và anốt xen kẽ, điều này đặt ra những thách thức về độ ổn định vật liệu và hoạt tính xúc tác điện. Bạch kim đã được sử dụng làm điện cực lưỡng chức trong các thử nghiệm chứng minh khái niệm ban đầu, và các nghiên cứu gần đây hơn đã khám phá việc sử dụng các chất xúc tác lưỡng chức có sẵn trên Trái Đất. Các chất xúc tác lưỡng chức này bị suy giảm hiệu suất sau một thời gian dài luân chuyển giữa các điều kiện tạo ra hydro và oxy.
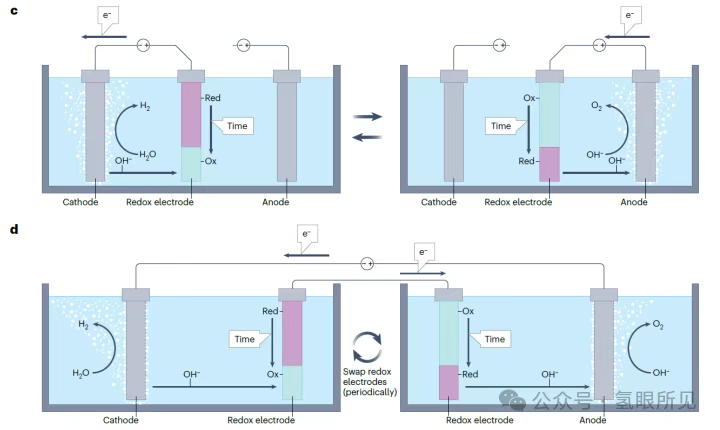
Hình 1: Quy trình điện phân nước tách rời. Điện phân nước tách rời (DWE) có thể được thực hiện trong các bình điện phân riêng biệt (quy trình liên tục) hoặc theo các bước riêng biệt (quy trình mẻ). c: Điện phân nước tách rời (DWE) kiềm sử dụng điện cực oxy hóa khử rắn trong bình điện phân ba điện cực như một quy trình mẻ. d: Quy trình điện phân nước tách rời bán liên tục sử dụng một cặp điện cực oxy hóa khử rắn trong bình điện phân hai ngăn. Ox: môi trường oxy hóa; Red: môi trường khử.
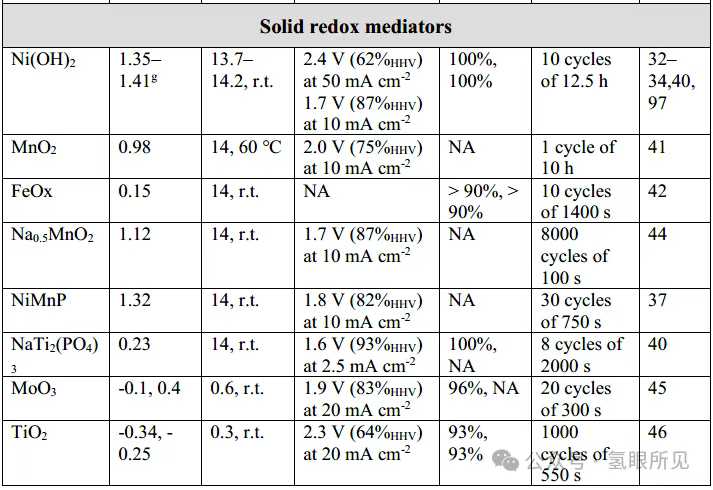
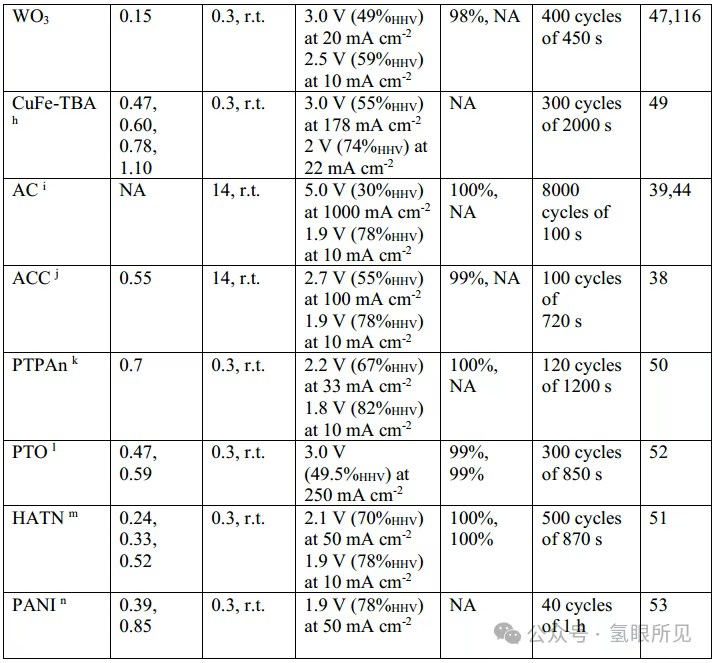
Ngoài Ni(OH)₂/NiOOH, các chất trung gian oxy hóa khử thể rắn khác tương tự như các chất được sử dụng trong siêu tụ điện và pin cũng đã được nghiên cứu. Chúng bao gồm các oxit kim loại (MnO₂, FeOₓ, CoO, Na₀.₅MnO₂, MoO₃, TiO₂, WO₃) và photphua (Ni-P, Ni-Mn-P), than hoạt tính, natri titan phosphat (NaTi₂(PO₄)₃), các chất tương tự xanh Teng (CuFe-TBA), và các chất bán dẫn hữu cơ như polytriphenylamine loại p (PTPAn), pyrene-4,5,9,10-tetraone loại n (PTO) và diquinoxalino[2,3-a:2’,3’-c]phenazine (HATN), cũng như các polyme lưỡng cực như polyaniline (PANI) (xem Bảng 1 ở trên). Hầu hết các vật liệu hữu cơ này có độ dẫn điện thấp (thường nằm trong khoảng từ 10⁻⁶ đến 10⁻¹⁰ S cm⁻¹), đòi hỏi phải bổ sung các tác nhân dẫn điện như than đen than chì. Hơn nữa, quá trình tổng hợp chúng đòi hỏi các thuốc thử đắt tiền, chẳng hạn như ruthenium clorua và natri periodate được sử dụng trong quá trình tổng hợp PTO, khiến việc sản xuất quy mô lớn trở nên khó khăn. Đáng chú ý, sự đánh đổi giữa tốc độ và hiệu suất đã được quan sát thấy trong mọi trường hợp (Bảng 1). Trong số các chất trung gian oxy hóa khử trạng thái rắn, Ni(OH)₂/NiOOH thể hiện điện áp pin thấp nhất là 1,7 V ở mật độ dòng điện chuẩn là 10 mA cm⁻². Độ ổn định hóa học và khả năng duy trì dung lượng cao là những cân nhắc chính khi lựa chọn chất trung gian oxy hóa khử trạng thái rắn và các điều kiện hoạt động của nó. Một hệ thống DWE thực tế phải có khả năng hoạt động trong hàng nghìn chu kỳ trong suốt vòng đời của nó. Ví dụ, một hệ thống chạy bằng năng lượng mặt trời hoạt động 6 giờ mỗi ngày phải chịu được khoảng 130.000 chu kỳ 10 phút trong một thập kỷ hoạt động. Hầu hết các chất trung gian oxy hóa khử cho DWE chỉ trải qua một vài chu kỳ, với một số chất trung gian oxy hóa khử trạng thái rắn được thử nghiệm trong tối đa vài nghìn chu kỳ (Bảng 1 ở trên) và biểu hiện sự suy giảm dung lượng sau hàng trăm hoặc hàng nghìn chu kỳ. Ví dụ, MoO₃ biểu hiện sự suy giảm dung lượng 22% sau 500 chu kỳ sạc-xả trong chất điện phân có tính axit ở mật độ dòng điện cao vượt quá 1000 mA cm⁻² do sự hòa tan một phần trong chất điện phân. Sự suy thoái nhanh chóng như vậy khiến nó không phù hợp với các hệ thống DWE thương mại. Đáng chú ý, điện cực Ni(OH)₂/NiOOH nổi tiếng về độ bền trong pin niken-kim loại hydride, loại pin đã được sử dụng trong các sứ mệnh không gian sâu và đã trải qua hàng chục nghìn chu kỳ sạc-xả mà không bị suy thoái. Phản ứng sạc-xả của chúng trong pin niken-kim loại hydride và DWE kiềm về cơ bản là giống hệt nhau, cho thấy rằng các điện cực này có thể đáp ứng các yêu cầu về tuổi thọ chu kỳ dài của các hệ thống DWE. Một thách thức khác với các chất trung gian oxy hóa khử trạng thái rắn (cũng như các chất trung gian hòa tan) là xu hướng làm giảm hiệu suất của bộ điện phân do tổn thất quá điện thế bổ sung trong quá trình sạc và xả. Tổn thất này được định lượng bằng một tham số được gọi là hiệu suất tách ghép. Hiệu suất tách ghép được tính bằng cách so sánh điện áp hoạt động của quy trình DWE hai bước với quy trình điện phân thông thường một bước không có chất trung gian (trong điều kiện hoạt động giống hệt nhau), tạo ra hình phạt năng lượng cần thiết để tách OER và HER. Các giá trị hiệu suất tách ghép là 94%, 90% và 97% đã được báo cáo cho các điện cực oxy hóa khử Ni(OH)₂, than hoạt tính và NaTi₂(PO₄)₃ ở mật độ dòng điện lần lượt là 2, 10 và 2,5 mA cm⁻². Trong khi đó, giá trị hiệu suất tách ghép là 87% đã được báo cáo đối với H₃PMo₁₂O₄₀, một chất trung gian oxy hóa khử hòa tan được sử dụng làm chất trung gian DWE, ở mật độ dòng điện là 100 mA cm⁻². Sự so sánh này không tính đến sự phụ thuộc vào mật độ dòng điện, mật độ này thay đổi tùy theo từng hệ thống. Thiếu sót này làm nổi bật nhu cầu về các điều kiện thử nghiệm thống nhất để đánh giá chuẩn hiệu suất của các hệ thống DWE khác nhau, như đã thực hiện đối với quá trình điện phân nước thông thường. Một thách thức khác trong việc sử dụng hiệu quả các chất trung gian oxy hóa khử trạng thái rắn cho DWE là đạt được mức sử dụng cao khả năng tích điện của chúng. Mức sử dụng công suất thấp đòi hỏi phải sử dụng một lượng lớn vật liệu oxy hóa khử để đạt được đủ thời gian và dòng điện cho chu trình DWE, làm tăng chi phí điện phân. Điện cực oxy hóa khử Ni(OH)₂/NiOOH có nguồn gốc từ các pin thương mại đạt mức sử dụng tối đa 50% khả năng điện cực trong quá trình hoạt động thuận nghịch ở mật độ dòng điện là 5 mA cm⁻². Các nỗ lực vận hành các điện cực này ở dòng điện cao hơn hoặc kéo dài thời gian sạc để kéo dài thời gian chu kỳ sẽ dẫn đến sự giải phóng oxy, một phản ứng phụ cạnh tranh với quá trình sạc Ni(OH)₂ thành NiOOH (do đó dẫn đến tổn thất Faradaic). Sự tạo ra oxy này đặt hệ thống vào tình trạng nguy hiểm nếu nồng độ oxy trong dòng hydro được tạo ra ở cực âm đạt đến giới hạn nổ dưới của O₂ trong H₂ (4% theo thể tích ở 20°C và áp suất khí quyển). Trên thực tế, nên áp dụng mức an toàn thấp hơn là 2% theo thể tích. Đạt được mức sử dụng công suất cao và mật độ dòng điện cao mà không sạc quá mức đến trạng thái kích hoạt các phản ứng phụ, chẳng hạn như sự giải phóng oxy trong điện cực Ni(OH)₂/NiOOH, là một thách thức chung đối với tất cả các điện cực pin khi sử dụng chất trung gian oxy hóa khử trạng thái rắn. Điều này được gọi là sự đánh đổi dung lượng-tốc độ. Nó bắt nguồn từ hiện tượng khuếch tán trạng thái rắn và chuyển pha xảy ra trong quá trình sạc các điện cực hai pha (như Ni(OH)₂/NiOOH). Không giống như các chất trung gian oxy hóa khử rắn, việc nạp và xả các chất trung gian oxy hóa khử hòa tan trong chất điện phân không bị hạn chế bởi vật liệu rắn. Thay vào đó, khả năng nạp của chúng bị giới hạn bởi giới hạn độ hòa tan, và tốc độ nạp bị giới hạn bởi sự khuếch tán của chúng vào điện cực (một hàm số của nồng độ, đối lưu, v.v.). Do đó, đối với các chất trung gian oxy hóa khử hòa tan có độ hòa tan cao (>0,5 M), giới hạn về dung lượng và tốc độ dường như ít gây ra vấn đề hơn. Trên thực tế, tỷ lệ sử dụng dung lượng (trên lý thuyết) của các chất trung gian oxy hóa khử hòa tan V³⁺/V²⁺ đã được báo cáo là 96%.
- Chu trình điện hóa – hóa học
Một phương pháp khác để xử lý DWE là sử dụng cặp oxi hóa khử thể rắn hoặc thể hòa tan để phân hủy phản ứng thoát hydro catốt (HER) hoặc phản ứng thoát oxy anốt (OER) trong quá trình điện phân thông thường thành các phản ứng điện hóa và hóa học. Phương pháp này yêu cầu nạp cặp oxi hóa khử đến trạng thái tích điện cao, với thế oxi hóa khử thuận nghịch dưới 0 VRHE (đối với các cặp oxi hóa khử có khả năng thoát hydro tự phát) hoặc trên 1,23 VRHE (đối với các cặp oxi hóa khử có khả năng thoát oxy tự phát). Hiệu điện thế giữa cặp oxi hóa khử tích điện và HER (0 VRHE) hoặc OER (1,23 VRHE) là động lực nhiệt động lực học (tức là suất điện động, EMF) gây ra sự thoát H/O tự phát trong các phản ứng hóa học. Các phản ứng hóa học này thường cần một hiệu điện thế lớn để cung cấp đủ động lực và tốc độ, trong khi hiệu điện thế nhỏ hơn là cần thiết cho hiệu suất năng lượng của quá trình DWE, tạo ra sự cân bằng tinh tế. Trên thực tế, hiệu điện thế khoảng 0,2 V đã được chứng minh là hoạt động tốt. Hiệu điện thế này thay thế cho quá thế quá trình giải phóng hydro hoặc oxy bằng điện hóa, cho phép các khí được tạo ra một cách tự phát (không cần năng lượng) trong các phản ứng hóa học tương ứng. Do đó, không giống như DWE sử dụng chất trung gian oxy hóa khử hòa tan hoặc rắn (có hiệu suất năng lượng thấp hơn so với điện phân nước truyền thống, xem Bảng 1), một số chu trình điện hóa-hóa học có thể được thực hiện với hiệu suất cao (xem Bảng 2).
3.1 Cặp oxi hóa khử hòa tan
Một ví dụ về một hệ thống DWE sử dụng cặp oxi hóa khử hòa tan cho chu trình điện hóa sử dụng axit silicotungstic (H₄SiW₁₂O₄₀) làm chất hoạt động oxi hóa khử. Giai đoạn đầu tiên của chu trình bao gồm quá trình khử điện hóa axit silicotungstic và quá trình oxi hóa nước, tạo ra oxy tại anot lưới bạch kim với hiệu suất Faradaic 100%. Axit silicotungstic khử (H₆SiW₁₂O₄₀) sau đó được chuyển sang một bình chứa chất xúc tác dạng bột, cho phép giai đoạn thứ hai (oxy hóa lại cặp oxi hóa khử và giải phóng hydro) diễn ra tự nhiên mà không cần bất kỳ nguồn điện hoặc nhiệt bổ sung nào. Hai giai đoạn này có thể được thực hiện song song trong một quy trình liên tục, tạo ra hydro và oxy trong các bình điện phân riêng biệt (Hình 2a bên dưới). Một ưu điểm chính của hệ thống này là tốc độ tạo hydro cực nhanh, không bị giới hạn bởi tốc độ giải phóng oxy bất lợi về mặt động học. Sau khi axit silicotungstic bị khử, hydro có thể được sản xuất nhanh chóng chỉ bằng một lượng nhỏ chất xúc tác platin. Sử dụng chất xúc tác platin-cacbon, tốc độ sản xuất hydro là 2,86 mol hydro trên mỗi miligam platin mỗi giờ, tương đương với 153 ampe trên mỗi miligam platin, nhanh hơn khoảng 30 lần so với tốc độ có thể đạt được trong các thiết bị điện phân tiên tiến nhất vào thời điểm đó.
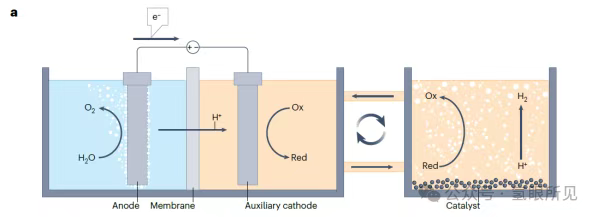
Hình 2: Quá trình điện phân nước tách rời trong chu trình điện hóa-hóa học. Điện phân nước tách rời (DWE) kết hợp các phản ứng điện hóa và hóa học để tạo ra hydro hoặc oxy trong một bình điện phân duy nhất (quy trình liên tục) hoặc trong các giai đoạn riêng biệt (quy trình mẻ). a: Quy trình liên tục sử dụng cặp oxy hóa khử hòa tan trong dung dịch điện phân có tính axit, xúc tác giải phóng hydro. ox: cặp oxy hóa khử; red: cặp oxy hóa khử.
Một quy trình DWE khác, sản xuất hydro và oxy trong các bình điện phân và bình xúc tác riêng biệt, sử dụng chất điện phân NaBr có tính kiềm yếu. Trong bình điện phân, các ion bromua (Br⁻) bị oxy hóa thành brom (Br₂) trên anot ổn định kích thước RuO₂-TiO₂/Ti. Br₂ tạo ra các ion bromat (BrO₃⁻) trong chất điện phân (Br⁻ + 6OH⁻ → BrO₃⁻ + 3H₂O + 6e⁻), trong khi hydro thoát ra ở catot bạch kim. Chất điện phân đã bị oxy hóa sau đó được chuyển đến bình xúc tác chứa chất xúc tác RuO₂, tại đây bromat bị khử trở lại thành bromua cùng với sự thoát ra của oxy (2BrO₃⁻ → 2Br⁻ + 3O₂). Chất điện phân khử sau đó được đưa trở lại bình điện phân, tại đây nó được oxy hóa lại, trong khi hydro được giải phóng ở catốt và chu trình lặp lại. Hiệu suất và mật độ dòng điện cao đã được chứng minh trong chất điện phân NaBr 1,5 M chứa đệm borat và phụ gia Na₂Cr₂O₇ (1 g L⁻¹) ở 60°C và pH 8-9. Điện áp pin là 1,8 V ở 10 mA cm⁻² và 2,4 V ở 1 A cm⁻² đã được báo cáo, tương ứng với giá trị hiệu suất pin lần lượt là 82% HHV và 62% HHV. Những kết quả này cho thấy quy trình này có tiềm năng vượt qua những thách thức của các phương pháp DWE trước đây và đạt được hoạt động liên tục hiệu quả, thông lượng cao. Nghiên cứu sâu hơn nên tích hợp các quy trình phụ điện phân và xúc tác và chứng minh hoạt động liên tục liền mạch, tính ổn định lâu dài và hiệu quả cao, cũng như thay thế catốt bạch kim và chất xúc tác RuO₂ bằng các giải pháp thay thế dồi dào, chi phí thấp và thay thế chất phụ gia Na₂Cr₂O₇ độc hại và gây ung thư bằng các giải pháp thay thế không nguy hiểm.
3.2 Chu trình điện hóa – hóa chất hoạt hóa nhiệt (E-TAC)
Niken (oxy) hydroxit có thể đóng vai trò là điện cực phụ trong DWE kiềm để trung gian trao đổi OH⁻ giữa catốt HER và anot OER. Nó cũng có thể được sử dụng để phân hủy OER thành các phản ứng điện hóa và hóa học, do đó thực hiện quy trình DWE không màng có thể được thực hiện trong bình điện phân không phân chia: anot Ni(OH)₂ pha tạp coban được nạp vào NiOOH (không giải phóng oxy) trong chất điện phân kiềm lạnh (khoảng 25°C) (tức là kiềm) trong khi hydro giải phóng ở catốt bạch kim. Sau đó, điện cực được ngắt khỏi nguồn điện và kiềm lạnh được thay thế bằng kiềm nóng (khoảng 95°C), kích hoạt phản ứng hóa học tự phát giữa anot tích điện và nước, khử nó trở lại Ni(OH)₂ trong khi tạo ra oxy (4NiOOH + 2H₂O → 4Ni(OH)₂ + O₂). Phản ứng tự xả này, giúp giảm khả năng lưu giữ dung lượng trong pin kiềm niken (oxy) hydride, được sử dụng một cách có cấu trúc ở đây để kích hoạt quá trình giải phóng oxy trong quá trình dao động, quá trình này phân tách quá trình tạo ra hydro và oxy thành các giai đoạn điện hóa (E) và hóa học hoạt hóa nhiệt (TAC), đồng thời đạt được sự phân tách không màng trong chu trình E-TAC (Hình 2b bên dưới). Quá trình này bao gồm phản ứng giải phóng oxy và phản ứng phóng điện NiOOH (thành Ni(OH)₂), xảy ra đồng thời bên trong điện cực mà không cần dòng điện bên ngoài (tức là trong điều kiện mạch hở).
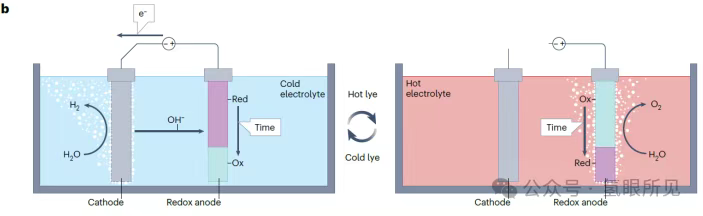
Hình 2: Quá trình điện phân nước tách rời trong chu trình điện hóa-hóa học. Điện phân nước tách rời (DWE) kết hợp các phản ứng điện hóa và hóa học để tạo ra hydro hoặc oxy trong các bình điện phân riêng biệt (quy trình liên tục) hoặc trong các giai đoạn riêng biệt (quy trình mẻ). b: Quy trình mẻ sử dụng điện cực oxy hóa khử rắn (anode) trong chất điện phân kiềm, giải phóng oxy trong phản ứng hóa học được kích hoạt nhiệt. ox: cặp oxy hóa khử bị oxy hóa; red: cặp oxy hóa khử bị khử.
Sản xuất hydro điện phân đã được chứng minh ở mật độ dòng điện trong khoảng từ 10 đến 200 mA cm⁻² và điện áp pin trong khoảng từ 1,4 đến 1,6 V, tương ứng với hiệu suất pin (điện áp) tương ứng là 10⁶ đến 93% HHV. Hoạt động điện áp thấp đã đạt được bằng cách thay thế phản ứng OER anốt bốn electron trong điện phân thông thường bằng phản ứng sạc Ni²⁺(OH)₂ một electron vào Ni³⁺OOH, sau đó là quá trình giải phóng oxy tự phát (không có nguồn điện) trong giai đoạn TAC. Anode Ni(OH)₂/NiOOH được pha tạp coban (khoảng 10 at%) để tăng khả năng sạc và ngăn chặn phản ứng phụ giải phóng oxy trong giai đoạn E. Không có oxy nào được tạo ra trong quá trình sạc ngắn (100 giây ở 50 mA cm⁻²), nhưng sau thời gian sạc dài hơn, anode bị sạc quá mức và quá trình giải phóng oxy bắt đầu. Sạc quá mức trong giai đoạn E sẽ hạn chế việc sử dụng dung lượng của anot niken (oxy) hydroxit. Việc sử dụng dung lượng phụ thuộc vào độ dày và cấu trúc vi mô của lớp Ni(OH)₂/NiOOH hoạt động được phủ trên đế. Một anot dày 10 μm được chế tạo bằng phương pháp điện phân lên đế bọt niken dày 3 mm với các lỗ rỗng 400 μm (độ xốp 95%) đạt được việc sử dụng dung lượng 5% trong quá trình tuần hoàn E-TAC thuận nghịch, trong khi một hạt xốp dày 2,4 mm bao gồm các hạt nano có lõi Ni và cấu trúc vỏ Ni(OH)₂ đạt được 15%. Đáng chú ý, điện cực Ni(OH)₂/NiOOH đạt được việc sử dụng dung lượng cao vượt quá 90% trong pin kiềm có thể sạc lại và 50% trong DWE với điện cực oxy hóa khử hỗ trợ Ni(OH)₂/NiOOH. Những kết quả này cho thấy rằng mặc dù điều kiện vận hành khác nhau, vẫn có chỗ để cải thiện khả năng sử dụng công suất của anot Ni(OH)₂/NiOOH trong quá trình điện phân nước E-TAC. Một thách thức khác là quản lý nhiệt để giảm thiểu tổn thất nhiệt từ việc tuần hoàn chất điện phân nóng và lạnh qua bình điện phân trong pha E và TAC. Bằng cách duy trì điện áp bình dưới điện áp nhiệt trung tính (1,56 V) cho toàn bộ phản ứng pha E (2Ni(OH)₂ → 2NiOOH + H₂, với nhiệt phản ứng chuẩn ΔH⁰ là 301,1 kJ mol⁻¹ H₂), pha E là thu nhiệt, làm mát hệ thống. Pha TAC là tỏa nhiệt (ΔH⁰ = -30,6 kJ mol⁻¹ O₂), làm nóng hệ thống. Do đó, các phản ứng E và TAC góp phần làm mát và làm nóng hệ thống tương ứng để duy trì nhiệt độ vận hành, giảm lượng nhiệt cần loại bỏ hoặc cung cấp bên ngoài. Tổn thất nhiệt phụ thuộc vào chênh lệch nhiệt độ giữa các giai đoạn quy trình liên tiếp, tỷ lệ vật liệu hoạt động oxy hóa khử (Ni(OH)₂/NiOOH) tạo ra nhiệt trong pha TAC cho các thành phần điện phân thụ động (như chất nền anot và catot) cần được làm nóng trong pha TAC và làm mát trong pha E, khả năng cách nhiệt của thành bình điện phân và các thông số vận hành như dòng điện, điện áp và trình tự quy trình. Việc đưa vào một bước rửa giữa các giai đoạn E và TAC, sử dụng chất điện phân có nhiệt độ vừa phải (60°C) để xả bình điện phân, giúp giảm tổn thất nhiệt và cải thiện an toàn vận hành bằng cách loại bỏ hydro hoặc oxy còn sót lại trong chất điện phân khi chuyển từ chất điện phân lạnh, giàu H₂ sang chất điện phân nóng, giàu O₂. Các tính toán cân bằng nhiệt chi tiết cho thấy tổn thất nhiệt có thể được giảm thiểu xuống mức thấp tới 2 kWh kg⁻¹ H₂ bằng cách cách nhiệt (bên trong) thành bình điện phân, tối ưu hóa kích thước của các thành phần bình điện phân và đạt được khả năng sử dụng công suất cao⁷⁰ của vật liệu hoạt động anot. Ngoài tiềm năng hiệu quả cao, một lợi thế khác của quy trình E-TAC là hoạt động không cần màng trong bình điện phân không chia tách, vì hydro và oxy được tạo ra riêng biệt ở các giai đoạn riêng biệt bằng cách sử dụng các luồng điện phân khác nhau.
- Chu trình điện phân và hòa tan kim loại
Một phương pháp khác để tách HER và OER bao gồm quá trình điện phân khử một lớp kim loại ở catốt và giải phóng oxy ở anot, sau đó là quá trình oxy hóa và hòa tan tự phát của lớp kim loại cùng với giải phóng hydro. Chu trình này đã được chứng minh bằng một quy trình hai giai đoạn trong dung dịch ZnSO₄/H₂SO₄. Ở giai đoạn đầu, Zn được điện phân ở catốt (Zn²⁺ + 2e⁻ → Zn), trong khi oxy được giải phóng ở anot (H₂O → ½O₂ + 2H⁺ + 2e⁻). Trong chất điện phân gốc sulfat, phản ứng tổng thể là ZnSO₄(dung dịch) + H₂O(l) → Zn(rắn) + H₂SO₄(dung dịch) + ½O₂(khí). Tiếp theo là sự hòa tan tự phát của lớp Zn được điện phân (Zn → Zn²⁺ + 2e⁻) và giải phóng hydro (2H⁺ + 2e⁻ → H₂) tại điện cực tương ứng, dẫn đến phản ứng tổng thể Zn(r) + H₂SO₄(aq) → ZnSO₄(aq) + H₂(g), với năng lượng tự do Gibbs chuẩn (ΔG⁰) là -181,5 kJ mol⁻¹. Bằng cách đặt một điện trở tải giữa các điện cực, một phần (30%) năng lượng điện được lưu trữ trong lớp Zn được điện phân ở giai đoạn đầu tiên được thu hồi ở giai đoạn thứ hai, phần còn lại được chuyển đổi thành hydro. Do đó, hệ thống hoạt động như một sự kết hợp của một bộ điện phân tách rời và một pin sạc, lưu trữ năng lượng điện và giải phóng oxy ở một giai đoạn và thu hồi một phần năng lượng được lưu trữ và sản xuất hydro ở giai đoạn còn lại. Các giai đoạn này có thể được thực hiện tuần tự trong cùng một bình điện phân hoặc đồng thời trong các bình điện phân riêng biệt. Ở giai đoạn đầu tiên, bình điện phân hoạt động trong 8 giờ ở mật độ dòng điện 40 mA/cm⁻² (diện tích điện cực 200 cm²) và điện áp đặt vào là 2,57 V (trung bình), tiêu thụ 164 Wh điện. Ở giai đoạn thứ hai, các điện cực được nối tắt thông qua một điện trở tải (0,2 Ω), tạo ra dòng điện tự phát 8 A (trung bình) và điện áp trung bình 0,78 V trong 8 giờ, trong đó 2,33 g hydro được tạo ra. Điện trở tải đã thu hồi một phần năng lượng được lưu trữ trong lớp Zn được điện phân trong giai đoạn đầu tiên (50 Wh, tổng lưu trữ là 164 Wh). Do đó, mức tiêu thụ năng lượng ròng là 114 Wh để sản xuất 2,33 g hydro, tương đương với hiệu suất điện phân là 49 kWh kg⁻¹ hoặc 80% HHV.

